A estrutura cristalina dos materiais é um tema fundamental na ciência dos materiais e na engenharia, descrevendo a organização dos átomos em um sólido, que influenciam diretamente suas propriedades físicas e mecânicas. A estrutura cristalina refere-se ao arranjo ordenado e repetitivo dos átomos em um material sólido. Esse arranjo é descrito por uma rede cristalina, que é uma matriz tridimensional de pontos onde cada ponto representa a posição de um átomo ou grupo de átomos. A unidade básica dessa rede é chamada de célula unitária, que se repete em todas as direções para formar o cristal. Os materiais cristalinos são contrastados com os materiais amorfos, que não possuem uma ordem de longo alcance em seus átomos. Exemplos de materiais cristalinos incluem a maioria dos metais, muitos cerâmicos e alguns polímeros.
Propriedades das Estruturas Cristalinas
A estrutura cristalina de um material influencia diretamente suas propriedades mecânicas, térmicas e elétricas. Algumas das propriedades mais são:
Densidade Atômica: A densidade atômica é a quantidade de átomos por unidade de volume. Estruturas como a CFC têm uma densidade atômica maior do que a CS, resultando em materiais mais densos e geralmente mais resistentes.
Número de Coordenação: O número de coordenação é o número de átomos vizinhos mais próximos de um átomo específico. Na estrutura CFC, o número de coordenação é 12, enquanto na CCC é 8. Um número de coordenação maior geralmente resulta em ligações mais fortes e materiais mais duros.
Fator de Empacotamento Atômico (FEA): O FEA é a fração do volume da célula unitária que é ocupada pelos átomos. Estruturas com um FEA maior, como a CFC, têm uma maior densidade e resistência.
Resistência Mecânica
A estrutura cristalina influencia diretamente a resistência mecânica do material, incluindo propriedades como dureza, tenacidade e resistência à tração. Materiais com estrutura CFC, como o cobre e o alumínio, apresentam boa ductilidade, enquanto estruturas CCC, como o ferro, tendem a ser mais duras, mas menos dúcteis.
Ductilidade
A ductilidade, que é a capacidade de um material se deformar plasticamente sem fraturar, é maior em materiais com estrutura CFC devido ao número maior de planos de deslizamento disponíveis para o movimento de discordâncias. Isso facilita a deformação plástica em comparação com outras estruturas, como a HCP, que têm menos planos de deslizamento.
Condutividade Térmica e Elétrica
A condutividade térmica e elétrica de um material está relacionada à mobilidade dos elétrons e à organização atômica. Materiais com estruturas cristalinas ordenadas e com alta densidade de átomos, como a CFC, tendem a ter boa condutividade elétrica e térmica, como o cobre e o ouro. Já em estruturas menos densas ou mais complexas, a condutividade pode ser menor.
Coeficiente de Expansão Térmica
A expansão térmica é a mudança dimensional que um material sofre quando aquecido. A estrutura cristalina afeta o coeficiente de expansão térmica. Materiais com ligações mais fortes entre os átomos, como o diamante (estrutura cúbica), tendem a ter coeficientes de expansão térmica mais baixos. Estruturas com empacotamento mais frouxo ou ligações mais fracas expandem-se mais com o aumento da temperatura.
Modularidade de Elasticidade
O módulo de elasticidade, que mede a rigidez de um material, também é influenciado pela estrutura cristalina. Materiais com estruturas cristalinas densas e fortes ligações atômicas, como o tungstênio (CCC) e o diamante (cúbico), apresentam altos módulos de elasticidade. Isso significa que eles são mais rígidos e menos suscetíveis a deformações elásticas.
Anisotropia
A anisotropia é a variação das propriedades mecânicas e físicas dependendo da direção cristalográfica em que são medidas. Algumas estruturas cristalinas, como a HCP, exibem anisotropia acentuada, com diferentes propriedades ao longo de diferentes eixos cristalográficos. Outras, como a CFC, tendem a ser mais isotrópicas, com propriedades semelhantes em todas as direções.
Tipos de Estruturas Cristalinas
Existem várias estruturas cristalinas possíveis, mas as mais comuns são as cúbicas e hexagonais. As estruturas cúbicas podem ser subdivididas em três tipos principais: cúbica simples (CS), cúbica de corpo centrado (CCC) e cúbica de face centrada (CFC).
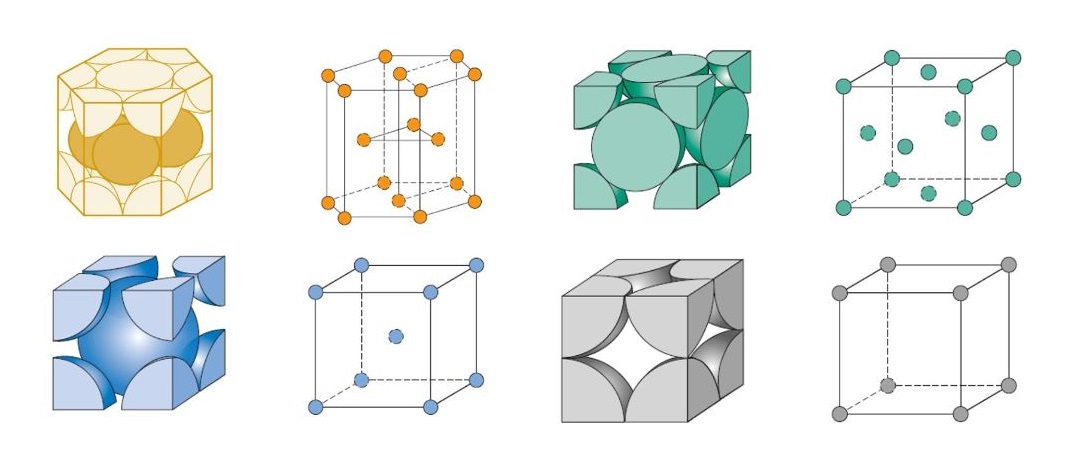
1- Cúbica Simples (CS): É uma das três principais formas de estrutura cristalina cúbica, caracterizada por uma disposição simples e simétrica dos átomos, onde cada um está localizado nos vértices de um cubo. É a estrutura mais simples, mas menos comum devido à sua baixa densidade atômica.
Características principais da estrutura cúbica simples:
Disposição dos átomos:
Os átomos estão localizados apenas nos oito vértices do cubo. Isso significa que a célula unitária é composta por 8 átomos, mas como cada vértice é compartilhado por 8 células unitárias vizinhas, o número efetivo de átomos por célula unitária é 1.
Número de coordenadação:
Na estrutura cúbica simples, cada átomo tem 6 vizinhos mais próximos (número de coordenação 6). Esses vizinhos estão posicionados nas direções de eixos ortogonais (x, y, z) ao redor de cada átomo.
Fator de empacotamento atômico (FEA):
O fator de empacotamento atômico (FEA) é relativamente baixo na estrutura cúbica simples, com um valor de aproximadamente 52%. Isso significa que pouco mais da metade do volume é preenchido por átomos, o que torna essa estrutura relativamente pouco densa em comparação com outras estruturas cúbicas.
Parâmetros de rede:
O parâmetro de rede, que define o comprimento da aresta do cubo, está relacionado ao raio do átomo (R) pela equação:
Exemplos de materiais:
Embora a estrutura cúbica simples seja teoricamente simples, ela é rara na natureza. Um exemplo de material que apresenta essa estrutura é o polônio (Po), um elemento radioativo.
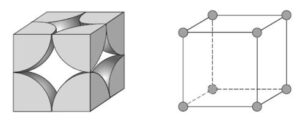
2- Cúbica de Corpo Centrado (CCC): É uma das principais formas de organização de átomos em sólidos cristalinos, caracterizada por uma célula unitária cúbica com um átomo em cada vértice do cubo e um átomo adicional no centro da célula unitária.
Características principais da estrutura cúbica de corpo centrado:
Disposição dos átomos:
Em uma célula unitária cúbica CCC, há átomos nos oito vértices do cubo, como na estrutura cúbica simples, mas também há um átomo adicional localizado no centro do cubo. Esse átomo central está em contato com os átomos dos vértices, o que dá à estrutura sua maior densidade de empacotamento em comparação com a cúbica simples.
Número de coordenação:
Cada átomo em uma estrutura CCC tem 8 vizinhos mais próximos, que são os átomos nos vértices do cubo ao redor do átomo central. Isso significa que o número de coordenação da estrutura cúbica de corpo centrado é 8.
Fator de empacotamento atômico (FEA):
O fator de empacotamento atômico (FEA) na estrutura CCC é aproximadamente 68%, o que significa que 68% do volume da célula unitária está ocupado por átomos.
Parâmetro de rede:
O comprimento da aresta da célula unitária está relacionado ao raio atômico (R) da seguinte forma:
Isso ocorre porque os átomos não se tocam ao longo das arestas, mas sim ao longo das diagonais que passam pelo centro do cubo.
Exemplos de materiais:
A estrutura BCC é comum em metais e ligas metálicas. Alguns exemplos de elementos que cristalizam em estrutura cúbica de corpo centrado incluem Ferro (Fe) à temperatura ambiente, (ferrita), Cromo (Cr), Tungstênio (W) e Molibdênio (Mo).
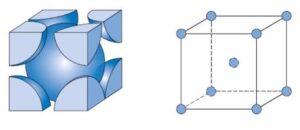
3- Cúbica de Face Centrada (CFC): Os átomos estão localizados nos vértices e no centro de cada face do cubo. Esta estrutura é encontrada em metais como o alumínio, cobre e ouro.
Características principais da estrutura cúbica de face centrada:
Disposição dos átomos:
Na estrutura CFC, os átomos estão localizados nos oito vértices do cubo e também no centro de cada uma das seis faces da célula unitária. Isso significa que existem 14 posições de átomos por célula unitária, mas como os átomos dos vértices são compartilhados por 8 células vizinhas e os átomos das faces são compartilhados por 2 células, o número efetivo de átomos por célula unitária é 4.
Número de coordenação:
Na estrutura CFC, cada átomo possui 12 vizinhos mais próximos. Esses vizinhos são organizados de forma que cada átomo esteja cercado por outros átomos dispostos em um padrão de face centrada. O número de coordenação 12 é um dos mais altos possíveis para estruturas cristalinas, indicando uma grande eficiência no empacotamento atômico.
Fator de empacotamento atômico (FEA):
O fator de empacotamento atômico, que mede a eficiência de preenchimento de espaço na célula unitária, é de aproximadamente 74% para a FCC. Isso significa que 74% do volume da célula unitária é ocupado por átomos, o que faz dessa estrutura uma das mais densamente empacotadas.
Parâmetro de rede:
O comprimento da aresta da célula unitária está relacionado ao raio atômico (R) pela equação:
Isso porque os átomos nas faces se tocam ao longo da diagonal da face do cubo.
Exemplos de materiais com CFC:
Muitos metais de uso comum cristalizam em estrutura CFC devido à sua alta densidade e estabilidade. Alguns exemplos incluem, Alumínio (Al), Cobre (Cu), Ouro (Au), Prata (Ag) e Níquel (Ni).
4- Hexagonal Compacta (HC):
A estrutura cristalina Hexagonal Compacta (HC) é uma das formas mais eficientes de organização dos átomos em sólidos, resultando em uma estrutura estável e com alto empacotamento atômico.
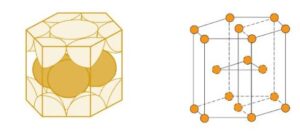
Disposição dos Átomos:
Na estrutura HCP, os átomos estão organizados em camadas sobrepostas em um padrão de empilhamento ABAB. As camadas “A” e “B” são dispostas de forma alternada, onde os átomos da segunda camada (B) ocupam os espaços vazios da primeira camada (A).
Número de Coordenação:
O número de coordenação, que indica a quantidade de átomos vizinhos ao redor de um átomo central, é 12 na estrutura HCP, ou seja, cada átomo está diretamente em contato com 12 outros átomos, contribuindo para a estabilidade e a compactação da estrutura.
Fator de Empacotamento Atômico (FEA):
O FEA da estrutura HC é cerca de 74% do volume total da célula unitária é ocupado por átomos. Esse valor é comparável ao fator de empacotamento das estruturas cúbicas de face centrada (CFC), o que demonstra a alta eficiência de preenchimento do espaço da estrutura hexagonal compacta.
Parâmetro de Rede:
O comprimento da aresta da célula unitária está relacionado ao raio atômico (R) pela equação:
Exemplos de Materiais com HC:
Muitos metais possuem estrutura HCP devido à sua densidade e resistência, como o magnésio (Mg), titânio (Ti), zinco (Zn) e berílio (Be). Esses materiais são vastamente utilizados em ligas metálicas e têm propriedades mecânicas adequadas para diversas aplicações industriais.